一个小小的芯片上,藏着破解癌症化疗耐药性的关键密码,它能够以单细胞精度预见肿瘤的耐药行为,为每位癌症患者量身定制治疗方案。
化疗后肿瘤再次复发——这可能是所有癌症患者和最担心的噩梦。为什么明明一开始化疗效果很好,肿瘤很快缩小,但一段时间后却又“卷土重来”?
答案就藏在肿瘤异质性这个复杂概念中。想象一下,一个肿瘤内部并非由完全相同的细胞组成,而是存在着多种不同的细胞亚群,就像一支拥有不同兵种的特种部队。
当我们使用化疗药物时,可能只消灭了其中一部分敏感细胞,而那些具有先天或后天耐药性的细胞亚群则存活下来,继续生长和增殖。
01 化疗困境:肿瘤异质性成为癌症治疗最大挑战
肿瘤异质性是指同一个肿瘤内部存在不同细胞亚群的现象,这些亚群在基因组、形态学和行为上有着显著差异。正是这种差异性,严重削弱了治疗干预的长期效果。
传统治疗策略,如适应性疗法和组合疗法,尝试整合多种不同机制的药物以达到协同治疗效果。然而,这些努力均无法建立基于对肿瘤异质性全面理解的治疗框架。
即使是在同一肿瘤区域取样的患者来源类器官,也往往包含多种细胞亚克隆,难以精确解析异质性驱动的耐药机制。
美国MD Anderson癌症中心的一项研究报告显示,化疗会引起小细胞肺癌肿瘤内异质性增加,从而导致多种耐药机制的发生发展。研究发现,小细胞肺癌治疗前在很大程度上是同源的,但治疗数周至数月内,会出现许多新的不同类型细胞。
由于不同细胞中多种耐药机制的产生,治疗变得异常困难。一些细胞可能通过一种机制产生抗药性,其他细胞则可能通过另一种机制产生抗药性。这意味着,针对一种抗药性的治疗只会杀死其中一部分细胞,而其他细胞则继续存活并增殖。
02 技术突破:微流控芯片揭开肿瘤异质性的神秘面纱
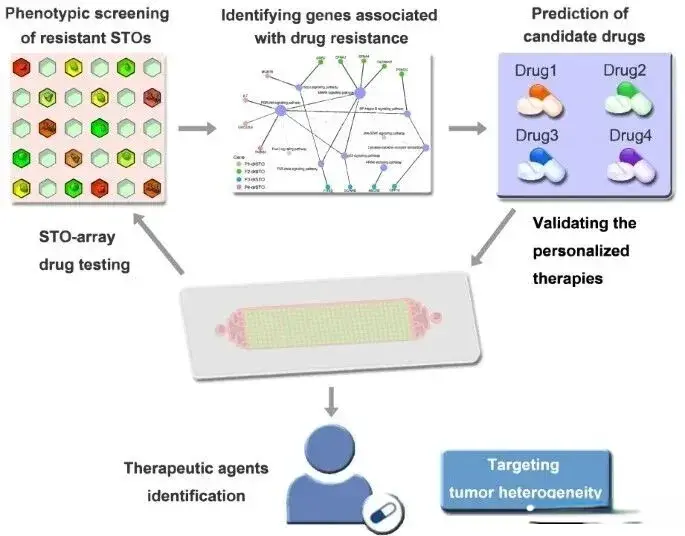
面对这一挑战,华南理工大学刘大渔研究员团队与暨南大学王丽辉教授团队开展合作,开发了一种基于微流控芯片的单细胞来源肿瘤类器官阵列技术(STO),为克服肿瘤异质性导致的耐药问题提供了创新平台。
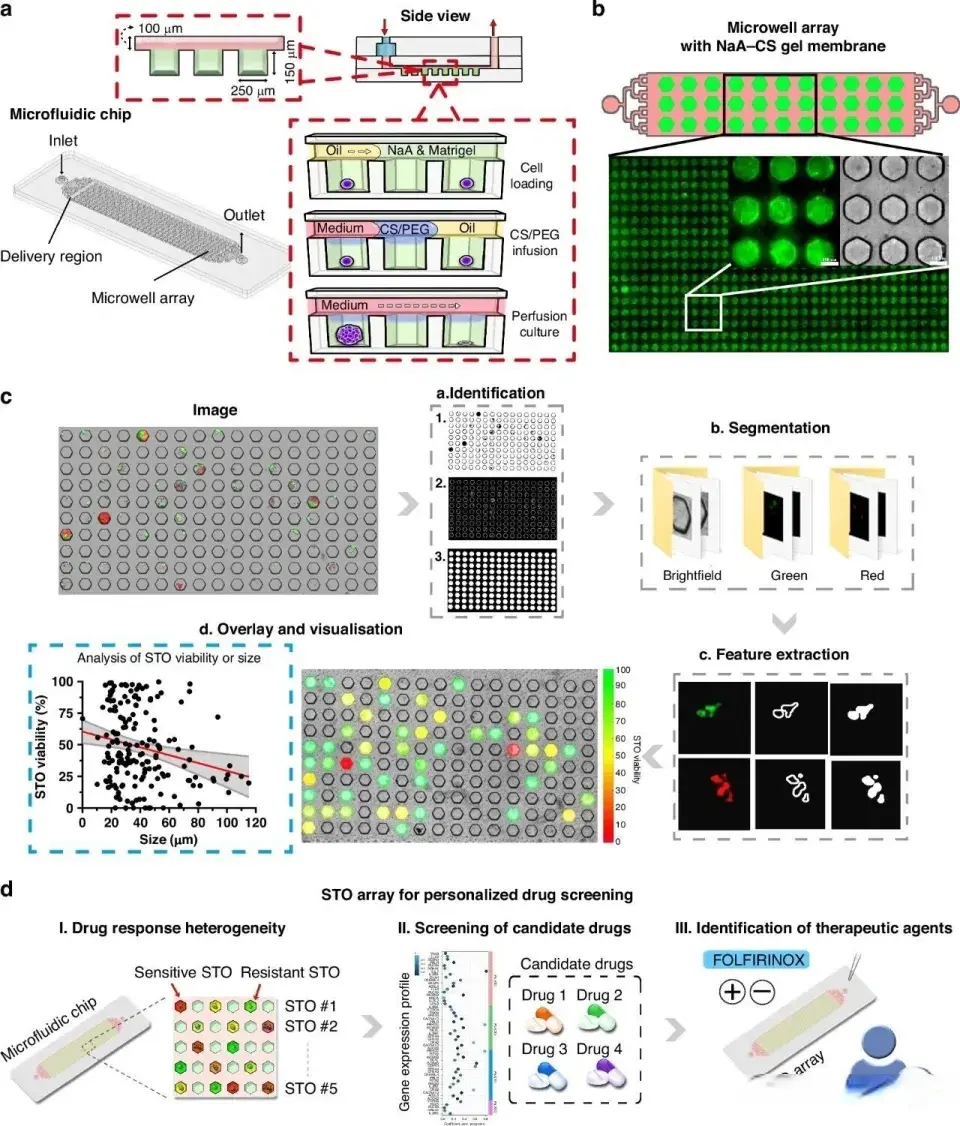
该技术的核心是一个微孔阵列格式的微流控芯片,能够通过随机捕获单细胞形成大规模STO阵列。这一设计具有两大关键特点:
首先,单个微孔中的STO来源于单个肿瘤干细胞,能够高分辨率展示细胞异质性。其次,数千个STO位于同一焦平面上的预定位置,便于使用成像数据进行自动化、高内涵分析。
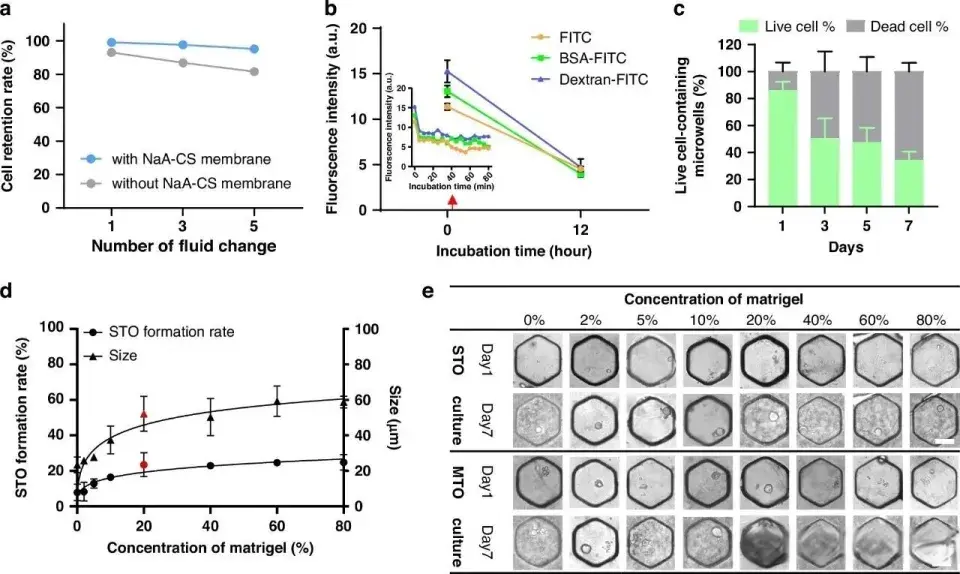
研究团队采用海藻酸钠-壳聚糖凝胶膜封装微孔阵列,防止细胞流失的同时为细胞长期培养提供了适宜环境。渗透性评估表明,该膜允许小分子、蛋白质和大分子进行交换,确保营养物质和代谢物的正常传输。
通过优化培养条件,团队在芯片上成功培养了来自4名结直肠癌患者的STO阵列,形成率在19.44%至35.57%之间。这些STO表现出与亲本肿瘤组织一致的基因组特征和组织学特征。
03 精准识别:发现肿瘤内的“耐药特种部队”
研究人员利用STO阵列评估了结直肠癌不同亚群对FOLFIRINOX常规化疗方案的反应差异。结果显示,STO表现出显著异质性的药物反应。
与多细胞来源的类器官相比,STO的存活率变化范围更广,表明其能更好地反映肿瘤内异质性。特别值得注意的是,较小的STO(≤40微米)比较大的STO(≥70微米)对化疗方案表现出更强的耐药性。
这一发现提示,肿瘤内存在具有不同耐药机制的细胞亚群,而STO阵列能够识别这些传统方法难以检测的耐药表型。
通过图像处理和自动化分析,研究人员能够定量评估每个STO的大小和活力变化,为研究肿瘤细胞对药物的异质性反应提供了宝贵工具。
在另一项关于化疗诱导肿瘤休眠的研究中,团队还发现,通过反复暴露于抗癌药物,肿瘤细胞会进入休眠状态,表现出药物耐受性增强、代谢活性降低和增殖能力减弱等特征。这些休眠细胞可能是肿瘤复发的“种子细胞”。
04 机制解析:从现象到本质的科学研究
基于耐药STO的转录组分析,研究人员发现了一系列与耐药性相关的基因上调,包括CDK1、KITLG、LEF1等。通过分析基因表达水平与预后的相关性,研究团队为每位患者识别出了特定的不良预后相关基因。
值得注意的是,不同患者之间的这些基因存在显著差异,体现了肿瘤的个体间异质性。
利用OncoPredict算法,研究人员筛选出针对这些耐药途径的候选药物,主要包括PI3K抑制剂、多靶点酪氨酸激酶抑制剂等。STO阵列药物测试证实,这些候选药物与常规化疗方案联用可显著增强肿瘤细胞清除效果。
此前,斯隆凯特林研究所的研究人员也发现了一种特别灵活的细胞状态,这种状态是肿瘤细胞亚群的特征,可以产生许多不同的细胞类型。这种高可塑性的细胞状态是肿瘤中大部分异质性的起点。
05 肿瘤微环境:耐药性的“帮凶”
肿瘤相关成纤维细胞是肿瘤微环境中数量最丰富的固有间质细胞成分,在恶性肿瘤治疗中起到了举足轻重的作用。中山大学孙逸仙纪念医院宋尔卫教授团队的研究发现,成纤维细胞并非铁板一块,而是具有高度异质性的。
研究人员将肿瘤标本中分离出来的成纤维细胞和肿瘤细胞进行共培养。结果发现,从耐药标本分离的成纤维细胞能诱导与其一同培养的肿瘤细胞耐受化疗药物的打击,而敏感标本分离的成纤维细胞则不能发挥这种“诱导”作用。
该研究利用CD10、GPR77这两个细胞膜蛋白鉴定出一个CD10+GPR77+成纤维细胞亚群,并发现这类型的成纤维细胞数目与乳腺癌及肺癌病人的预后和化疗敏感性相关。
在动物模型中,使用GPR77膜蛋白的阻断抗体联合化疗药物治疗,能够显著增强移植瘤的化疗敏感性。这为靶向微环境逆转肿瘤耐药的治疗提供了新靶点。
06 临床应用:从实验室到病床的转化路径
STO阵列技术有望成为精准肿瘤医学领域的关键工具。随着类器官培养技术的标准化和微流控芯片成本的降低,将会推动这一方法走向临床应用,为癌症患者提供真正个性化的治疗解决方案。
想象一下,医生只需获取患者少量肿瘤组织,培养一周左右,就能在芯片上筛选出最有效的药物治疗方案,避免患者经历无效治疗的痛苦和时间浪费。
这种技术特别有价值的应用场景之一是新辅助化疗的疗效预测。对于结直肠癌等恶性肿瘤,术前新辅助化疗可以缩小肿瘤体积,提高手术成功率。但并非所有患者都能从化疗中获益,如果能提前预测化疗敏感性,将避免患者接受无效治疗带来的副作用和时间延误。
此外,对于晚期癌症患者,这一技术可以帮助医生快速确定最有效的药物组合,提高治疗效果,延长患者生存时间。
07 挑战与展望:肿瘤耐药研究的未来方向
尽管STO技术取得了重要突破,但研究人员指出,该技术仍存在一些局限性。例如,微流控芯片上的STOs可能无法完全复制肿瘤内部的细胞外基质、免疫细胞、成纤维细胞和其他细胞类型,这些都是影响肿瘤行为的关键因素。
此外,微流控芯片上的STOs不包含血管系统,而血管在肿瘤生长、转移和对治疗的响应中起着至关重要的作用。肿瘤在体内是动态发展的,包括肿瘤细胞的增殖、迁移和分化,STOs可能无法完全模拟这种动态过程。
未来的研究可以进一步优化该平台,例如引入免疫细胞和基质细胞以更接近体内肿瘤微环境,从而为开发新型抗癌策略提供更有力的支持。
随着单细胞转录组测序等技术的发展,我们将能更深入地理解肿瘤异质性的分子基础,为开发针对特定细胞亚群的精准治疗提供更多线索。
08 个体化医疗:未来癌症治疗的新范式
这项技术的意义不仅在于提供了一种新的实验工具,更在于它代表了一种治疗范式的转变——从传统的“一刀切”式化疗,转向真正意义上的个体化医疗。
随着这项技术的发展,医生可能不再仅仅基于癌症的类型和分期来决定治疗方案,而是能够根据患者肿瘤内特定细胞亚群的特征来精准选择药物,实现“量体裁衣”式的治疗。
对于存在特定耐药亚群的患者,医生可以选择包含针对性药物的组合方案;而对于肿瘤异质性程度较低的患者,则可能选择更为简单的治疗方案,在保证疗效的同时减少不必要的副作用。
这种治疗策略的转变,将大大提高肿瘤治疗的效果,减少无效治疗,改善患者的生活质量,最终实现精准肿瘤医学的承诺。
随着更多研究的开展和技术的进一步成熟,我们有望在不远的将来,将癌症转变为一种可以长期管理甚至治愈的疾病,让无数患者和家庭从中受益。
未来的癌症治疗,医生或许不再需要尝试多种化疗方案才能找到有效的那个。他们会取一小片肿瘤组织,在微流控芯片上培养一周,就能准确知道哪种药物组合对患者最有效。