自从信达生物的PD-1/IL-2双特异性融合蛋白IBI-363验证了初步成药性后,市场对于激活免疫细胞及增强自身的免疫力抗肿瘤的药物开发方向热度急剧升温。
除了IL-2之外,IL-12、IL-15也进入市场视野,三者均能够显著激活和促进NK细胞(自然杀伤细胞)和细胞毒性T细胞(CD8⁺ T细胞)的增殖与功能,而这些细胞正好是杀伤肿瘤的主力军。
本文重点关注IL-12,和IL-2一样,未经修饰的IL-12具有严重的全身毒性,目前看下来通过遮蔽技术修饰的IL-12、与PD-1靶点联合组成双特异性融合蛋白或改为瘤内注射的溶瘤病毒能够解决其安全性问题,促使其有望成为强效的癌症免疫治疗剂理想靶点。
9月9日,Xilio Therapeutics公布了旗下肿瘤激活型IL-12管线XTX301的积极结果(针对晚期实体瘤患者1/2期研究),在2例晚期实体肿瘤患者出现PR(一次已确认,一次未确认),而在剂量水平高达RP2D时患者耐受性良好,大多数治疗相关不良事件为1级或2级。
另外,今年5月Imunon的IL-12基因疗法IMNN-001也在一项针对晚期卵巢癌患者二期研究中取得积极结果,该疗法通过独有的递送平台将带有IL-12的DNA质粒递送至腹膜腔,从而在目标部位局部表达IL-12,激活T细胞和NK细胞,达到杀伤肿瘤的效果;在该研究中,接受IMNN-001联合治疗组的患者相比对照组mFS增加了11.7个月、mOS增加了13个月。
IL-12的成药潜力,逐步显现。
01 IL-12靶点的功能性
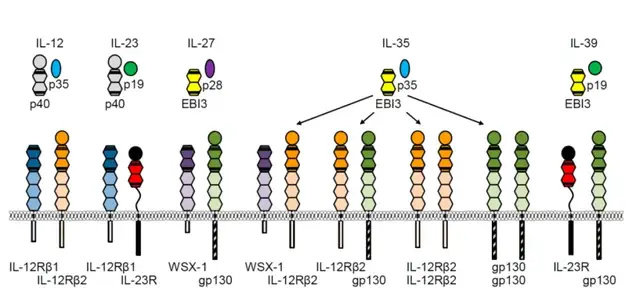
IL-12(白细胞介素-12)是一种由抗原提呈细胞(如树突状细胞、巨噬细胞)分泌的异二聚体细胞因子,其由p35和p40两个亚基组成,能够促进Th1细胞的分化,增强细胞免疫应答,特别是在抗病毒和抗肿瘤免疫中发挥重要作用,尤其在促进Th1型免疫应答和抗肿瘤免疫中至关重要。
(IL-12家族)
IL-12的核心功能主要有几个:1)促进Th1细胞分化 - 通过STAT4信号通路,驱动初始CD4+T细胞向Th1方向分化,抑制Th2/Th17路径;2)增强细胞毒性 - 激活NK细胞和CD8+T细胞,提升其杀伤能力,促进干扰素-γ(IFN-γ)分泌;3)抗肿瘤免疫 - 激活Th1和CTL(细胞毒性T淋巴细胞),在多种肿瘤模型中表现出强效抗肿瘤活性;4)抗感染免疫 - 在抗胞内病原体中起关键作用;
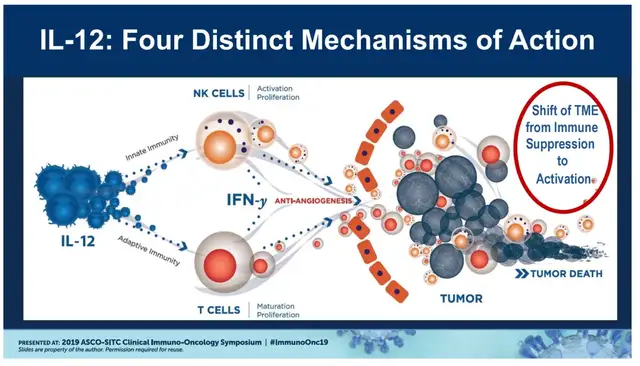
在抗肿瘤领域,IL-12拥有强大的免疫激活能力,强力促进T细胞和NK细胞的增殖与活化,并刺激它们产生IFN-γ(可激活巨噬细胞,增强吞噬和杀伤能力),能通过多级联动重塑肿瘤微环境(TME)。另外,尽管IL-12诱导的IFN-γ可能会上调肿瘤细胞表面的PD-L1表达,但联合使用PD-1/L1抑制剂和开发双特异性抗体/融合蛋白有望实现协同增强抗肿瘤效果。
基于IL-12强大的免疫激活能力,研发者也探索不同的路径在发挥其抗肿瘤功能的同时尽最大限度规避其全身毒性问题:
1)通过前药技术(遮蔽技术)避免在血液循环中触发毒副作用,直到在肿瘤微环境释放活性IL-12,激活Th1免疫应答;
2)与PD-(L)1靶点组合形成双抗或融合蛋白,减弱IL-12活性,利用PD-(L)1靶点精准导向肿瘤细胞的同时降低IL-12的毒性;
3)基因疗法,通过不同的递送系统(LNP、病毒或外泌体等)递送IL-12编码基因,在目标细胞内翻译为活性IL-12蛋白,从而实现杀伤肿瘤并避免传统的IL-12分子在血液循环中的毒性问题;
02 海外的一些领先开发者
关于IL-12新型疗法的开发,海外的Biotech是领先的,同时也给了国内开发者不同的思路。
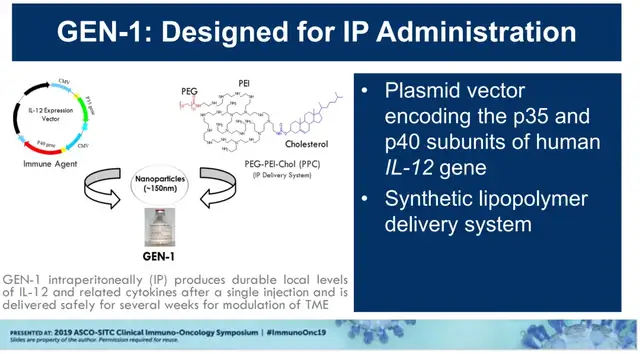
先说前面提到Imunon公司的IL-12基因疗法IMNN-001,其由专有的TheraPlas平台技术开发的IL-12 DNA质粒载体,包裹在纳米颗粒递送系统中,能够在细胞转染后持续、局部分泌IL-12蛋白。
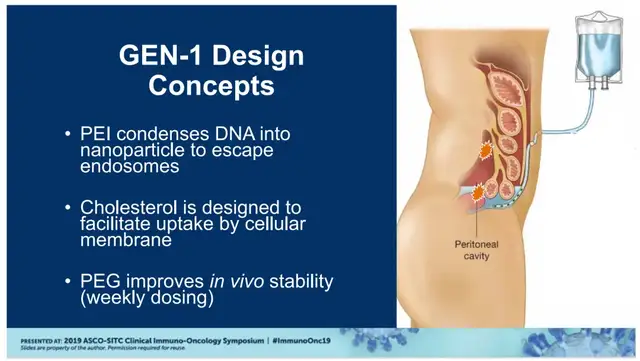
基于目标适应症卵巢癌的特征,公司在给药层面是有“巧思”的,它并不是使用传统的静脉注射,而是采用的腹腔内给药。卵巢癌的肿瘤微环境主要集中在腹腔,局部精准注射有助于最大化免疫激活效率,同时避免全身毒性。
为此,公司特别设计了“PEG(聚乙二醇)-PEI(聚乙烯亚胺)-Chol(胆固醇)”腹腔内给药系统,PEG作用是改善体内稳定性(实现每周一次给药),PEI能够通过将DNA压缩成纳米颗粒并帮助DNA逃避内吞体的降解,胆固醇则是有助于细胞膜摄取。
分子结构和给药方式的双重设计,也促使IMNN-001在二期研究取得成功。
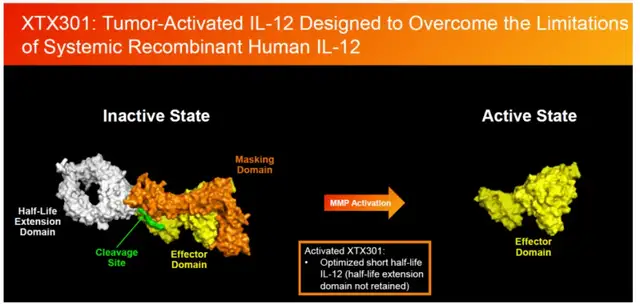
同样前面提到的Xilio Therapeutics,其代表性管线XTX301是一种IL-12融合蛋白,设计同样具备自己的特色。
XTX301由IL-12异源二聚体、N端掩蔽多肽、蛋白酶敏感接头和半衰期延长结构域组成,在非活性状态下该分子静脉给药血浆半衰期可达14个小时,这时N端掩蔽多肽发挥作用利用空间位阻阻断IL-12在血液循环中与受体的结合;进入肿瘤微环境(TME)后,TME中失调活性的基质金属蛋白酶(MMP)切割蛋白酶敏感接头,并且遮蔽多肽和半衰期延长结构域一起脱落,活性IL-12半衰期缩短至<2 h,从而兼顾系统安全性与局部药效。
Xilio独特的设计,在XTX301的前瞻性少量数据得到一定验证,包括观察到2例患者PR,以及RP2D剂量大多数患者不良反应为1级或2级,耐受性良好。公司另一款核心管线,Vilastobart(CTLA-4前药)也在冷肿瘤转移性MSS结直肠癌观察到了不俗的响应率。
海外的这些Biotech先行者虽然为后来者打了个样,可Imunon、Xilio两家公司的市值仍然属于“微盘股”的范畴,证明市场或许认为这些公司技术成熟度不足或者存在取巧嫌疑,又或者希望看到更多大样本量的数据。
03 国内也在冲刺
皮球又踢回到国内,有哪些Biotech在IL-12靶点上做出了一些创新?
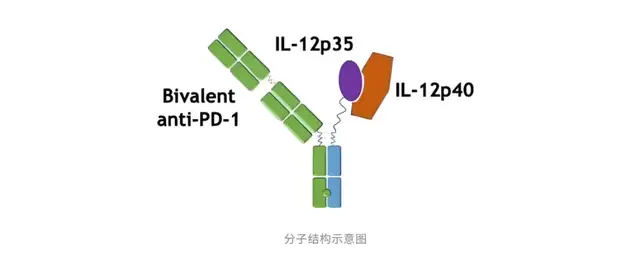
关注度最高的莫过于信达生物的anti-PD1/IL12融合蛋白IBI-3026,其在今年8月初获得了CDE的临床批件。
信达生物的IBI-3026同样有巧思,其一部分采用了双价的高亲和力PD-1,另一部分采用了效力减弱的IL-12变体(突变降低活性)。这样独特的设计好处在于,临床前数据显示:IBI-3026被弱化到在没有PD1分子帮助的情况下基本不结合IL-12受体,保证全身给药的安全性;同时,IBI3026可以有效地富集到PD-1+T细胞中,在TME中IL-12可以借助PD-1顺势激活T细胞,以在肿瘤微环境中实现最大化的IL-12激活。
IBI-3026后续的人体临床数据值得关注,其潜力或许不弱与IBI-363。
溶瘤病毒Biotech亦诺微的思路也非常清奇,MVR-T3011是亦诺微在1型单纯疱疹病毒(HSV-1) 的基础上进行基因改造而成的溶瘤病毒,特殊的工程化改造确保了病毒能选择性地在肿瘤细胞内大量复制,最终导致肿瘤细胞裂解死亡。
另外,MVR-T3011的基因组中分别整合了整合了IL-12的基因、抗PD-1单链抗体(scFv) 的基因,这意味着病毒能在肿瘤局部感染细胞,MVR-T3011在细胞内成为一个“原位工程”,一方面发挥IL-12功能促进T细胞和NK细胞的增殖与活化,另一方面直接生产PD-1抗体并分泌到肿瘤微环境中。
值得注意的是,MVR-T3011不受传统溶瘤病毒“瘤内注射”的限制,其也可以静脉给药,治疗那些瘤内注射无法触及的转移病灶。MVR-T3011在国内20名三线头颈癌患者(治疗含铂化疗及PD-1均无效)的早期疗效探索数据显示:患者整体CR率为20%,DCR控制率为65% 。
信达生物、亦诺微之外,国内还有更多研发参与者在在IL-12药物改造领域各出奇招,比如嘉晨西海LNP封装的自复制RNA(srRNA)药物,再比如奥赛康的遮蔽技术目前应用在各类细胞因子靶点身上(奥赛康曾将细胞因子改造平台的部分专利授权给Xilio)。
结语:信达生物IBI-363的初步验证,向市场打开了一条思路,便是利用细胞因子靶点激活和促进人体自身免疫系统抗肿瘤的策略是能够达到高效低毒效果的,而继IL-2之后,或许同样强效激活的免疫系统的IL-12,也能出现一款大药。